中国基因治疗发展简史
基因治疗的概念是在20世纪70年代初提出来的,最初的概念是引入一个正常的基因来取代一个突变基因,虽然现在有更多的替代方法,如基因编辑和碱基编辑,但它仍然是我们高度依赖的主要策略之一。
2012年欧洲批准 Glybera,这是西方国家首个基因治疗产品,也是全球首个针对基因疾病的基因治疗。尽管Glylbera在商业上并不成功,但它打开了基因治疗的大门。在随后的几年里,一些基因治疗产品陆续涌入市场,Strimvelis于2016年在欧洲获得批准,CAR-T疗法(Kymriah和Yescarta)和Luxturna分别于2017年获得美国食品和药物管理局(FDA)的批准。
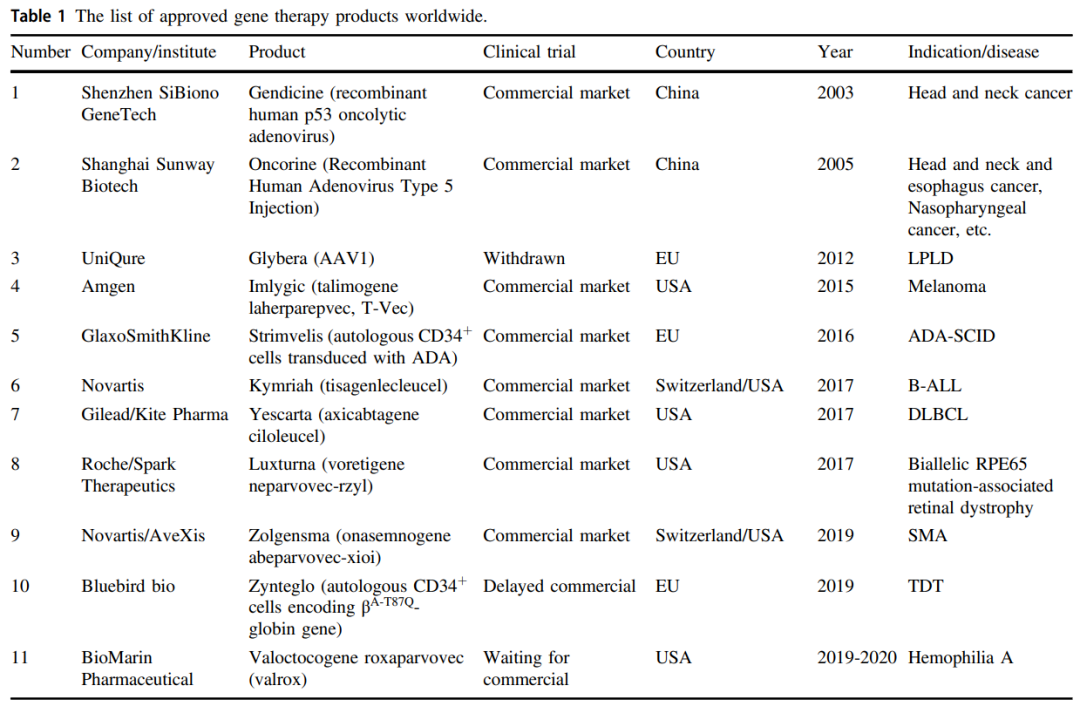
中国很早就接受了基因治疗,中国的第一个基因治疗临床试验可以追溯到1991年,距离1990年美国国立卫生研究院(NIH)首次进行基因治疗仅一年。此外,中国在2003年批准了世界上第一个基因治疗产品Gendicine(今又生),Gendicine是一种具有p53的溶瘤腺病毒,用于治疗晚期头颈癌。第一个CRISPR临床试验也在中国进行。中国的基因治疗既有国际共同点,又有自己的特点。
中国的基因治疗现状
血友病
中国血友病患病率为每10万人3.6人,男性患病率为5.5/10万,低于普遍报告的全球流行率——每10万人10人。然而,考虑到我国人口众多,这是影响众多家庭的最具影响的遗传病之一。
1991年,在中国进行了血友病B(HB)基因治疗的临床试验,这是继美国ADA-SCID试验后仅一年的世界上第二次人类基因治疗试验,也是第一次人类血友病基因治疗试验。血友病A(HA)和HB是严重的X连锁出血性疾病,主要影响男性。HA和HB分别由血液中因子VIII(FVIII)或因子IX(FIX)的缺陷或减少引起。
血友病基因治疗在二十一世纪取得了迅速的进展。然而,在我国,从1991年开始,到现在还没有进一步的血友病临床试验。目前,clinialtrials.gov上登记有两项临床试验,一项由天津市血液病医院研究所发起,采用单剂量静脉注射BBM-H901的AAV载体进行HB基因治疗(NCT04135300),目前正在招募3名参与者。另一项深圳市遗传免疫医学院发起,慢病毒FVIII基因修饰HSPC移植HA试验(NCT03217032),但临床试验至今仍处于未招募状态。目前,重点仍集中在基础研究工作。
β地中海贫血
引起血红蛋白β-珠蛋白链表达减少或消除的突变可导致β-地中海贫血。目前,已经鉴定出200多种影响人类β-珠蛋白基因的突变。在中国,由β-珠蛋白基因内含子2的654位核苷酸C到T替换引起的β654地中海贫血是最常见的形式,约占β-地中海贫血病例总数的五分之一。β地中海贫血在中国南部包括广西、广东和海南省最为流行。特别是在广西,有20-31.5%的人口是地中海贫血基因携带者。
从美国和欧洲的临床试验来看,β-地中海贫血的基因治疗在安全性和有效性方面取得了巨大成功。然而,β地中海贫血基因治疗在我国尚处于起步阶段。关于β-地中海贫血基因治疗的疗效,还没有公开的临床数据,甚至临床前研究的数量也非常有限。
体细胞基因编辑的临床试验
体细胞基因编辑通过治疗遗传病、传染病和获得性疾病,在体内显示了它的潜力。基因编辑的临床试验从ZFN开始,ZFN首次应用于“柏林病人”的HIV体外基因治疗。ZFN的试验现已扩展到血友病、法布里病、MPS II和珠蛋白营养不良。2019年,美国FDA批准了基因编辑临床试验(NCT03872479),使用EDIT-101对遗传性严重视网膜营养不良Leber先天性黑矇10型(LCA10)进行体内治疗,EDIT-101是第一个体内CRISPR试验。
在中国,迄今为止所有的基因编辑试验都是基于CRISPR导向的体外策略。来自四川大学的LU等人首次在临床试验中使用CRISPR敲除自体T细胞上的PD-1,目的是治愈非小细胞肺癌(NCT02793856)。根据最近公布的数据,12名患者接受自体PD-1编辑的T细胞输注,植入PD-1阴性T细胞似乎是安全的。杭州市肿瘤医院开展的另一项试验采用了相同的策略,治疗晚期食管癌患者(NCT03081715)。然而,本试验的临床结果尚未发表,因此很难评价其安全性和有效性。最近,Xu等人报道使用CRISPR敲除HSPC中的CCR5受体基因,并将其移植到同时患有HIV和急性淋巴细胞白血病的患者身上。尽管没有证据表明对HIV有治疗作用,但该研究首次在人类证据中表明CRISPR至少在19个月的随访期间是安全的,这可能会鼓励使用CRISPR编辑的HSPC进行其他体外基因治疗,如β-地中海贫血和镰状细胞疾病。
人类胚胎的基因编辑
2015年,Huang等人报道了人类胚胎中第一个CRISPR基因编辑。为了减少伦理压力,他们使用了三原核(3PN)合子,这种合子有一个卵母细胞核和两个精子核,与植入后的自然流产有关。他们发现CRISPR能高效切割人类胚胎中的内源性β-珠蛋白基因(HBB)。重要的是,这项研究还表明,人类胚胎中的基因编辑远未成熟,已编辑胚胎的高脱靶率和嵌合体率也很高。
然而,2018年,南方科技大学的副教授贺建奎用CRISPR对人类胚胎进行基因编辑,目的是制造基因编辑的婴儿。这是在科学和道德层面上都非常严重的不当行为。他的行为引起了国际社会的激烈批评,并受到政府、中国科学界和民众的强烈谴责,改变生殖细胞将不可逆转地改变人类基因库,违反了现行国际规范和中国现行法规。最后,他在2019年12月因此被判刑3年。显然,有必要建立一个更广泛的国际框架来管理人类基因组编辑。
溶瘤病毒
2003年,我国批准了世界上第一个基因治疗产品Gendicine。两年后的2005年,上海三威生物科技公司开发的另一种溶瘤病毒Oncorine(rAd5-H101)被中国食品药品监督管理局(CFDA)批准用于治疗晚期鼻咽癌。然而,根据clinicaltrial.org上的公开信息,从那时起,溶瘤病毒在中国的临床试验就中断了。直到2019年,三个临床试验才开始积极招募。其中,有两项是I期研究,旨在评估表达GM-CSF的减毒HSV-2作为单一药物或与PD-1抗体联合使用的安全性和有效性(NCT03866525和NCT04386967)。OV在中国停止的临床试验反映出,自Gendicine以来,OV的疗效一直没有得到根本改善,直到最近。
中国基因治疗企业概况
朗信生物
朗信生物科技有限公司(Innostellar Biotherapeutics Co.,Ltd)是一家致力于基因治疗创新药研发制造及商业化的全球化企业。公司目前关注在遗传性疾病的基因治疗领域(眼科、罕见病、单基因遗传疾病),已有多个管线产品研发及工业化技术开发基础。
信念医药
信念医药创立于2016年9月,是一家集基因治疗药物研发、生产和临床应用为一体的高科技企业。BBM-H901注射液是信念医药开发的一款AAV基因治疗药物,旨在通过静脉给药将人凝血因子IX(Factor IX,FIX)基因导入血友病B患者体内,从而提高并长期维持患者体内凝血因子水平,以期达到“一次给药、长期有效”的治疗及预防出血效果。BBM-H901注射液药物的设计采用了肝靶向性血清型和高效基因表达盒,目前已进入临床阶段。
中因科技
北京中因科技是一家专业从事遗传性眼病临床基因诊断、生育预防和基因治疗药物研发的国家高新技术企业,也是国内率先进行眼科基因治疗药物研发的企业。2021年8月13日,美国食品和药品监督管理局(FDA)已授予其在研原创新药“重组人CYP4V2基因腺相关病毒注射液”(ZVS101e注射液)孤儿药资格认定,用于治疗结晶样视网膜色素变性(BCD)。
芳拓生物
方拓公司由泓元资本与奥博资本共同发起设立,公司致力于建立具有拓展性的、规模化基因治疗药物研发平台,研发和生产高质量的、患者可负担的rAAV载体基因治疗产品,满足全球患者一针治愈的临床治疗需求。公司产品线覆盖眼科、血液、遗传代谢性疾病、神经肌肉等多个疾病领域。
纽福斯
2021年7月,眼科疾病的基因治疗公司纽福斯宣布,中国首个临床阶段的眼科体内腺相关病毒(AAV)基因治疗药物NR082(NFS-01)用于ND4线粒体基因突变引起的Leber遗传性视神经病变(LHON)第一阶段临床试验在中国完成首例患者入组及给药。NR082是国内首个获得临床试验许可的眼科体内AAV基因治疗药物,并已于2020年9月获得美国FDA孤儿药认定,为该产品加速国际化开发奠定了基础。
辉大基因
辉大基因成立于在2018年,致力于通过创新的CRISPR基因编辑技术研发单基因罕见疾病和威胁人类健康的慢性病的基因替代和基因编辑等基因治疗药物。2021年5月,辉大基因完成4亿元B轮融资。目前辉大基因拥有三大研发平台:基因编辑平台、递送载体平台、动物模型平台。
博雅辑因
博雅辑因是一家以基因组编辑技术为基础,针对多种疾病加速药物研究并开发创新疗法的生物医药企业,在2020年10月顺利完成4.5亿元人民币的B轮融资。2021年4月21日,博雅辑因宣布顺利完成4亿元人民币的B+轮融资。本轮融资资金将被用于继续推进公司以基因编辑技术为基础的产品管线的临床转化,并推动公司的产业化发展。
中吉智药
中吉智药是一家集基因治疗创新药物的研发、生产、销售为一体的生物制药企业,在基因表达调控和基因治疗领域拥有超过20年的深厚底蕴,已布局多个罕见遗传病基因治疗项目。2021年10月,公司已经完成Pre-A轮数千万元人民币融资,投资方为其瑞佑康。融资款项用于推动并完成RDEB基因治疗IIT研究,以及β-地中海贫血基因治疗的IIT研究。
鼎新基因
上海鼎新基因科技有限公司由生物制药领域资深管理团队和科学家团队联合创立,创始团队均有15+年生物医药及基因治疗相关研究经验。作为一家以基因治疗药物研发为核心的生物医药创新研发企业,致力于打造国际一流的基因治疗研发平台,并不断开发First-in-class及Best-in-class基因治疗药物。
嘉因生物
杭州嘉因生物科技有限公司(简称“嘉因生物”)成立于2019年7月,位于杭州省级医药港小镇,是一家致力于面向全球市场提供安全有效基因疗法的创新药企。其不仅在研发管线、技术平台等方面具有差异化的竞争优势,在病毒生产工艺及大规模量产方面更是具备国际领先的水平。
九天生物
九天生物医药(上海)有限公司(Geneception)成立于2019年,聚焦世界前沿的基因和细胞治疗领域,立足中国,放眼全球。针对罕见病及癌症治疗领域,推动新药研发与上市,满足病患需求。据悉,九天生物A轮总融资金额1.5亿美元。
诺洁贝生物
诺洁贝生物成立于2020年3月,由基因治疗领域资深的科学家、企业家联合创立,致力成为具有国际影响力的全球领先的基因治疗公司。2021年4月,苏州诺洁贝生物技术有限公司已完成3000万美元A轮融资,此轮融资主要用于诺洁贝生物多款基因治疗管线的临床产品的准备和cGMP生产车间的建设。
鼐济医药
鼐济医药是一家集基因治疗药物研发、生产和临床应用为一体的高新技术企业,成立之初已完成近亿元融资,致力于通过国际前沿的基因治疗技术,为多种遗传疾病和癌症加速药物研究以及开发创新疗法。拥有一支具备丰富的基因治疗和细胞治疗研发经验的专业管理团队,团队在基因治疗技术、药物开发与生产、临床研究以及注册申报等各个重要环节均拥有丰富经验。
珠海贝斯昂科
贝斯生物于2021年4月正式成立。该公司由在生物医学领域具有20年临床医生、科研、创业、和风险投资经验的徐天宏博士发起创立,专注于研发新型基因编辑NK细胞治疗产品及基因治疗产品。贝斯生物近日完成近亿元天使轮融资,该轮融资资金将主要用于贝斯生物独特的基因编辑NK平台及基因治疗平台的升级、产品研发、专利池的构建以及相关团队建设。
吉凯基因
吉凯基因设立至今,一直利用RNAi等技术,开展药物靶标发现及其衍生业务。公司业务覆盖靶标筛选及验证、抗体药物及基因治疗/细胞治疗药物的临床前研究以及I期临床研究等药物开发流程中的源头创新阶段。目前公司通过自主创新研究已主要开发了15个进入IND研究阶段的新药研发项目,其中7个已许可或转让,公司仍在继续开发的项目中有1个进入IND申请阶段。
至善唯新
至善唯新成立于2018年,是一家专注rAAV基因药物研发与生产的基因治疗企业,治疗领域涵盖血液疾病、罕见病等。2021年2月,至善唯新宣布完成数亿元人民币A轮融资。
北京合生基因
2020 年 11 月 27 日,合生基因宣布其基于国内原创的合成生物技术开发的首款基因治疗产品 SynOV1.1 获得美国 FDA 临床试验许可,用于治疗包括中晚期肝癌在内的甲胎蛋白(AFP)阳性实体瘤。
原基华毅
原基华毅目前已开发多条基因治疗研发管线。该公司由首都医科大学校长,著名学者饶毅教授创立。旗下公司有华毅亮健等。
邦耀生物
公司科学家团队在基因编辑工具开发和基因治疗地中海贫血领域,已经持续取得一系列突破性进展,利用基因编辑技术重新开启胎儿期的γ珠蛋白的表达,代替有缺陷的β珠蛋白,期待成为治愈地贫患者的治疗方案之一。
新芽基因
新芽基因成立于2020年7月,由何春艳博士和常兴博士联合创立。2021年7月,苏州新芽基因生物技术有限公司宣布已完成数千万人民币Pre-A轮融资。
目镜生物
上海目镜生物医药科技有限公司是一家专注于基因工程化定向进化技术开发新型AAV外壳用于眼科疾病基因治疗技术和产品研发的创新公司。作为一家创新型生物医药企业,公司致力于为全球眼科疾病患者带来光明。目镜生物具有丰富的AMD及其他眼科疾病基因治疗产品临床前研发经验,目前已有一款AMD基因治疗的候选药物。
丹瑞生物
上海丹瑞生物医药科技有限公司是一家临床阶段的创新型生物医药公司,成立于2018年4月。丹瑞中国自成立之初便一直推动普列威(Provenge)在中国的上市,并致力于将丹瑞美国前沿的免疫细胞治疗技术转移到中国。丹瑞中国希望将自身经验服务于行业,打造中国细胞和基因治疗的产业化加速器。
此外,药融云数据显示,目前还有领诺医药、神拓生物、渤因生物、克睿基因、恒瑞医药、安龙生物、天泽云泰、和度生物、星明优健、本导基因、锦篮基因、正序生物、康璟生物、人福医药、北海康成、诺思兰德生物、瑞风生物、神曦复生、劲威生物、华大吉诺因、信立泰、康霖生物、华药康明、荷塘生华、继景生物、吉脉基因等企业致力于基因治疗相关新药开发。
中国基因治疗的监管
中国科学家早在上世纪80年代末90年代初就开展了基因治疗的基础研究和临床试验。基因治疗监管政策最早于1993年出台,到目前为止,监管政策的演变大致可以分为三个阶段。
第一阶段(二十世纪末)
1993年,国家科委颁布了《基因工程安全管理办法》,但这一规定并未对基因治疗做出具体规定。同年,卫生部药监局发布了《人体体细胞治疗与基因治疗临床研究质量控制要点》,为基因治疗提供了具体的质量控制指南,对促进基因治疗的快速发展发挥了重要作用。1999年,国家药监局颁布了《新生物制品批准办法》和《药物临床试验管理规范》,将基因治疗纳入生物新产品和药物临床试验的监管范围。因此,在基因治疗领域,中国至今形成了技术和药物两条监管路径,以及科技、卫生、药品等主管部门实施的多元监管模式。总体来看,这个阶段的监管政策相对宽松,调控措施相对粗糙。
第二阶段(二十一世纪前15年)
21世纪初,我国已形成了较为全面但仍宽松的基因治疗监管政策。2003年,国家食品药品监督管理局颁布了三项有关人类基因治疗的规定。科技部、卫生部联合发布了《人类胚胎干细胞研究伦理指导原则》。卫生部根据《人类辅助生殖技术管理办法(2001)》,制定了《人类辅助生殖技术技术规范》和《人类辅助生殖技术和人类精子库伦理原则》,制定了禁止以生殖为目的的基因治疗临床试验的政策。
2007年,卫生部发布了《涉及人体的生物医学研究伦理审查办法(试行)》,初步规定了基因治疗的伦理审查程序。2009年,卫生部发布了《医疗技术临床应用管理办法》,将基因治疗列为第三类应当审批的医疗技术。
2009年,卫生部还发布了《脐血干细胞治疗技术管理规范(试行)》和《基因芯片诊断技术管理规范》。2010年,国家食品药品监督管理局发布了《药品临床试验伦理审查指导原则》。2015年,国家卫生计生委、国家食品药品监督管理局联合发布了《干细胞临床研究管理办法(试行)》、《干细胞制剂质量控制和临床前研究指导原则(试行)》等监管措施和伦理准则。同年,国家卫生计生委取消了第三类医疗技术临床应用的行政审批,细胞治疗和基因治疗可由医疗机构自行审批。
第三阶段(2016年至今)
这一时期的特点是技术和产业促进、权利保护和风险控制相协调的综合监管政策。2016年“生物免疫疗法”魏则西事件发生后,国家卫生计生委立即暂停所有未经批准的第三类医疗技术临床应用,基因治疗监管政策趋于严格,但生物技术仍然属于国家重点推进发展的领域。
在技术和产业推广方面,基因治疗无论是作为一种新的医疗技术,还是作为一种生物医药产业,都具有广阔的前景。在国务院“十三五”国家战略性新兴产业发展规划(国发[2016]67号)、“十三五”国家科技创新规划(国发[2016]43号)中,《新建六个自由贸易试验区方案》(国发〔2019〕16号)等与经济社会发展有关的纲领性文件都对基因治疗领域的产业发展给予了鼓励政策。
而针对人类基因技术尚未形成系统的法律规定体系(包括基因治疗),在法律(狭义)层面上对基因治疗没有直接的规定。现行的监管规范主要是技术管理方法或伦理准则。我国基因治疗的法律(广义)框架主要包括国务院发布的行政法规、部门规章和国务院各部委发布的规范性文件。
受CRISPR婴儿事件影响,中国正在生物安全、基因技术和生物医学等领域加紧立法。2019年,《生物安全法》通过全国人大常委会第一次审议。中央全面深化改革委员会第九次会议审议通过了“国家科技伦理委员会架构”,致力于推动建立覆盖面广、导向明确的科技伦理综合治理体系。中国国家卫生和科技部门正在采取相应的立法行动,起草了《生物医药新技术临床应用管理规定(征求意见稿)》和《生物技术研究开发安全管理规定(征求意见稿)》,目标是形成更加合理的监督机制,加强监督,增加法律责任,促进生物技术研发、应用及相关产业的健康发展。
小结
虽然近年来基因治疗在我国方兴未艾,但要缩小与西方国家的差距,仍有许多工作要做。首先,我们认为公众教育对基因治疗的成功至关重要。基因治疗作为一门新兴的医学门类,正在深刻地改变着医药行业的格局,然而,它还远未成熟,也就是说,还有许多未知数有待探索。当发生严重不良事件时,公众的态度可能直接决定基因治疗的命运。
第二,稳定的资金至关重要。从基因治疗的历史来看,我国起步较早,但与同期的美国和欧洲相比,进展缓慢且十分有限。
第三,中国目前对基因治疗的监管复杂繁琐。如何协调不同的规范,简化规定,有利于我国基因治疗的研究和发展。基因治疗的对象通常是那些身体状况不好的人,他们迫切需要新的治疗方法来改善他们的健康状况和获得生命的机会。更好的法规应该有助于缩短从研究到临床应用的时间。
参考资料:
1.Strategies to Circumvent the Side-Effects of Immunotherapy Using Allogeneic CAR-T Cells and Boost Its Efficacy: Resultsof Recent Clinical Trials. Front Immunol. 2021; 12: 780145.
2. 药融圈:中国基因治疗企业全景概览
3. 药融云数据
来源于小药说药 ,作者小药说药
保护地热搜
- 《中国自然资源报》理论版刊发邓侃文章:做好固碳减碳的林业文章 | 阅140944
- 《中国林业》杂志刊发邓侃文章:解读“森林是钱库” | 阅120381
- 物种通用数据 | 阅20347
- 西溪国家湿地公园模式的实践与探索 | 阅16372
- 唐雪琼:后新冠疫情期间的云南自然保护地社区生态旅游发展 | 阅13942
- 我国湿地现状如何?如何解读第25届世界湿地日主题? | 阅13916
- 日本国家公园保护管理观察 | 阅11250
- 2023年生物科技趋势:合成生物占据“C位” | 阅10703
- 红树林该如何保护才科学 | 阅10647
- “两山”理念提出15周年 | 南山国家公园:探索南方丘陵山地自然保护新模式 | 阅9649
| 我也说两句 |
| 版权声明: 1.依据《服务条款》,本网页发布的原创作品,版权归发布者(即注册用户)所有;本网页发布的转载作品,由发布者按照互联网精神进行分享,遵守相关法律法规,无商业获利行为,无版权纠纷。 2.本网页是第三方信息存储空间,阿酷公司是网络服务提供者,服务对象为注册用户。该项服务免费,阿酷公司不向注册用户收取任何费用。 名称:阿酷(北京)科技发展有限公司 联系人:李女士,QQ468780427 网络地址:www.arkoo.com 3.本网页参与各方的所有行为,完全遵守《信息网络传播权保护条例》。如有侵权行为,请权利人通知阿酷公司,阿酷公司将根据本条例第二十二条规定删除侵权作品。 |
 m.quanpro.cn
m.quanpro.cn
